Von Froschschenkeln zu Batterien: Wie funktioniert ein Energiespeicher?
Ein bisschen Geschichte: Die Entdeckung der Elektrizität
Luigi Galvani war ein italienischer Arzt und neugieriger Wissenschaftler im 18. Jahrhundert. Während eines Experiments zur Untersuchung von Froschschenkel-Muskeln entdeckte er einen Zusammenhang zwischen geschichteten Metallen und dem Zusammenzucken der Froschschenkel. Als Galvani die Muskeln ausversehen mit einer Messingstange an ein Metallgitter stieß, zuckten diese zusammen. Ihm war klar, dass hier die Elektrizität eine Rolle gespielt hat – aber was genau passierte, wurde erst einige Jahre später festgestellt.
Der italienische Physiker Alessandro Volta erkannte auf Basis der Entdeckung von Galvani, dass mit Hilfe von zwei verschiedenen Metallscheiben und einer in Salzwasser getränkten Lederscheibe dazwischen elektrische Spannung erzeugt werden kann. Volta stapelte zuerst eine Zinkscheibe, dann eine feuchte Lederscheibe und anschließend eine Silberscheibe übereinander. Dies wiederholte er mehrere Male und erschuf die Volta-Säule – die erste technisch anwendbare Batterie.
Zu Ehren dieser wissenschaftlichen Entdeckungen wurde:
- Die physikalische Einheit der Spannung (Volt) nach Volta benannt
- Die Kombination aus Zink-, Silber- und Lederscheiben als Galvanische Zelle bezeichnet
Die Galvanische Zelle bildet die Basis für alle modernen Batteriezellen.
Ein paar Grundlagen: Edle und unedle Metalle
Was hat die Kombination aus Silber, Zink und salzgetränktem Leder auf sich? Um das zu beantworten, müssen zuerst ein paar grundlegende Begriffe erklärt werden.
Die Elektronenabgabe- und Aufnahmefähigkeit von Metallen ist der Grundbaustein, um die Funktionsweise einer Batterie zu beschreiben:
| Metallart | Eigenschaften | Beispiele |
|---|---|---|
| Edle Metalle | Rosten nicht, reagieren wenig mit anderen Stoffen, behalten Elektronen und können weitere aufnehmen | Silber, Gold, Platin |
| Unedle Metalle | Sehr reaktionsfreudig, rosten, geben Elektronen ab | Zink, Eisen, Aluminium |
Die wichtigsten Begriffe der Batterietechnik
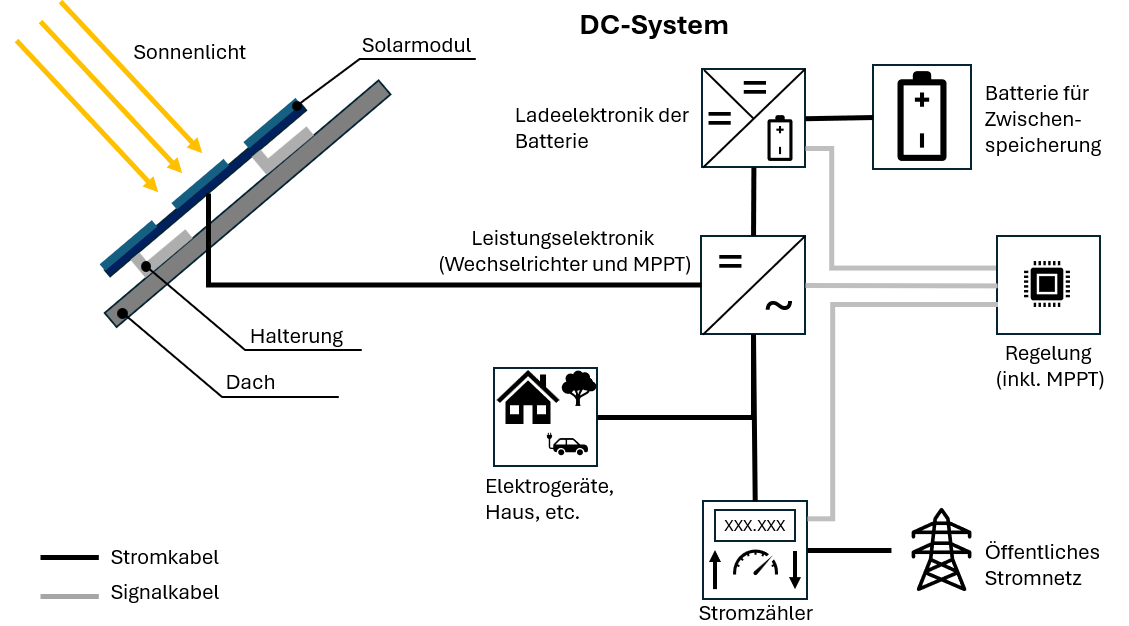
Anode: Die negative Elektrode (Minuspol), besteht aus unedlem Material, gibt Elektronen ab.
Kathode: Die positive Elektrode (Pluspol), besteht aus edlem Material, nimmt Elektronen auf.
Elektrolyt: Eine Flüssigkeit oder ein Feststoff, der mit Hilfe von geladenen Teilchen (Ionen) elektrischen Strom leiten kann.
Separator: Trennt Anode und Kathode, lässt aber Ionen durch – verhindert Kurzschluss.
Funktionsprinzip im Detail: Der Entladeprozess
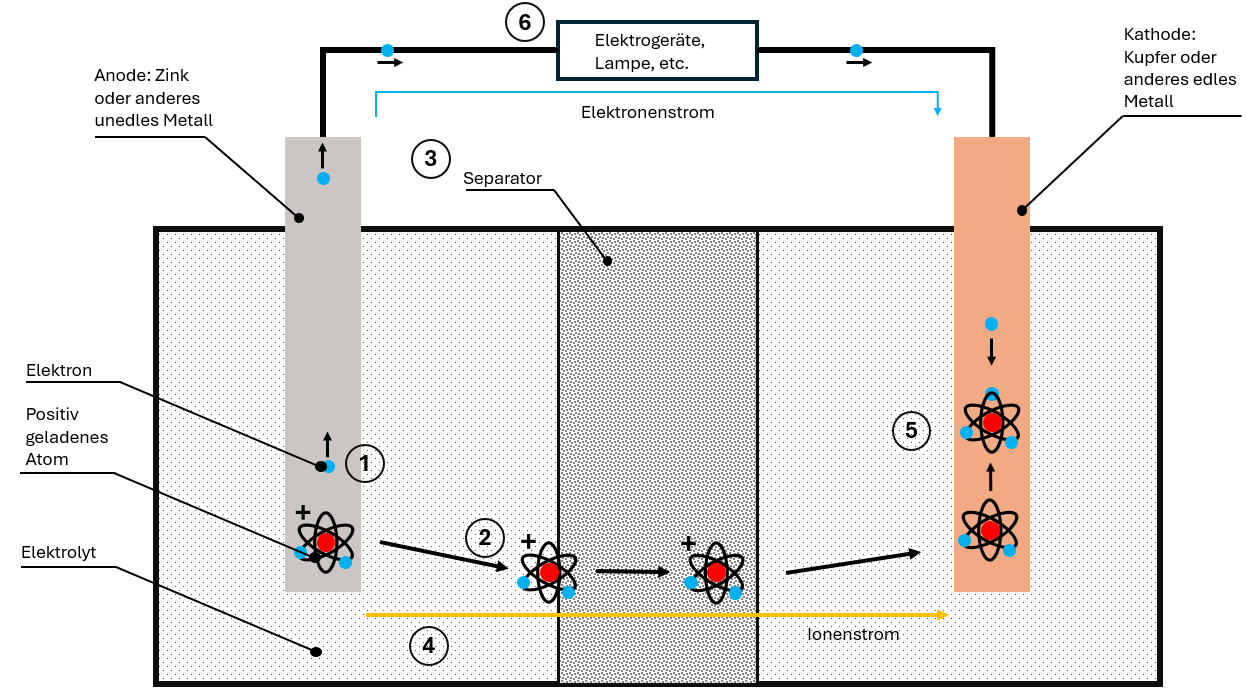
Die Standard-Batteriezelle setzt sich aus vier Komponenten zusammen:
- Anode (Minuspol)
- Kathode (Pluspol)
- Elektrolyt
- Separator
So funktioniert die Entladung:
- Elektronenabgabe: Die unedle Anode gibt Elektronen ab, die durch das Kabel zur Kathode wandern
- Ionenbildung: Durch den Elektronenmangel bilden sich positiv geladene Ionen in der Anode
- Ionenwanderung: Die Ionen lösen sich im Elektrolyt und wandern durch den Separator zur Kathode
- Zwei getrennte Ströme:
- Elektronenstrom durch das Kabel (nutzbar!)
- Ionenstrom durch den Elektrolyt
- Wiedervereinigung: In der Kathode werden Elektronen und Ionen wieder vereint
Der Elektronenstrom ist Gleichstrom – er fließt immer in eine Richtung und kann für elektrische Geräte genutzt werden. Chemische Energie wird so in elektrische Energie umgewandelt.
Der Ladeprozess: Alles rückwärts
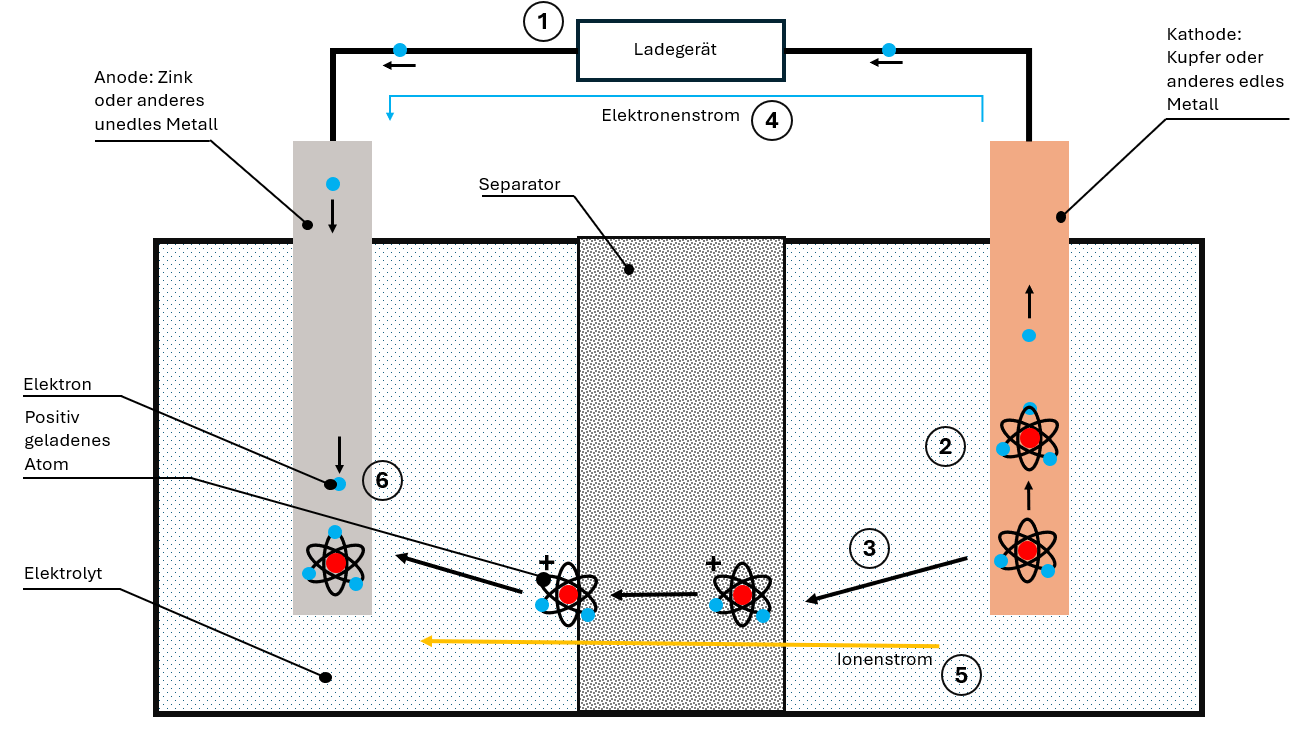
Beim Laden wird vom Ladegerät eine entgegengesetzte Spannung angelegt. Dadurch kehrt sich der gesamte Prozess um:
- Die Kathode "verliert" ihre Elektronen, die zur Anode wandern
- Ionen lösen sich aus dem Kathodenmaterial
- Die Ionen bewegen sich durch Elektrolyt und Separator zur Anode
- In der Anode werden Ionen und Elektronen wieder eingelagert
Die Batterie ist wieder aufgeladen und bereit für den nächsten Entladezyklus.
Wichtige Fachbegriffe und Einheiten
Lebensdauer und Ladezyklen
Ein Ladezyklus ist der Vorgang einer vollständigen Ent- und Beladung. Moderne Lithium-Ionen-Batterien schaffen je nach Typ zwischen 1.000 und 4.000 Zyklen.
Entladetiefe (DoD – Depth of Discharge)
Die Entladetiefe gibt an, zu wie viel Prozent die Batterie entladen wurde:
- 0% DoD = Batterie vollständig geladen
- 100% DoD = Batterie vollständig entladen (vermeiden!)
Jede Batterieart hat eine maximale empfohlene Entladetiefe. Bei Unterschreitung wird die Batterie beschädigt.
C-Rate: Lade- und Entladegeschwindigkeit
Die C-Rate beschreibt das Verhältnis zwischen Lade-/Entladeleistung und Kapazität:
C-Rate = Leistung (kW) / Kapazität (kWh)
| C-Rate | Lade-/Entladezeit | Bedeutung |
|---|---|---|
| 0,25C | 4 Stunden | Schonende Ladung |
| 0,5C | 2 Stunden | Standard Heimspeicher |
| 1C | 1 Stunde | Schnellladen |
| 2C | 30 Minuten | Hochleistung |
Beispiel: Eine Batterie mit 10 kW Leistung und 20 kWh Kapazität hat eine C-Rate von 0,5C – sie lädt oder entlädt sich in 2 Stunden.
Energiedichte
Das Verhältnis zwischen gespeicherter Energie und Bauraum:
- Volumetrisch: Wh pro Liter (Wh/l)
- Gravimetrisch: Wh pro Kilogramm (Wh/kg)
Lithium-Ionen-Batterien mit LFP-Kathoden erreichen etwa 200 Wh/kg – deutlich mehr als Blei-Säure-Batterien.
Memory-Effekt
Dieses Phänomen beschreibt die Minderung der Kapazität durch das Aufladen einer nicht vollständig entladenen Batterie. Die Batterie "merkt" sich den verkürzten Ladezyklus und gibt nur noch einen entsprechenden Teil der Kapazität ab.
Gut zu wissen: Moderne Lithium-Ionen-Batterien sind vom Memory-Effekt praktisch nicht betroffen – anders als ältere Nickel-Cadmium-Batterien.
Übersicht: Die wichtigsten Einheiten
Für die Arbeit mit Batterien und Solaranlagen sind einige Einheiten und Kennzahlen besonders wichtig. Die folgende Tabelle fasst die wesentlichen Größen zusammen:
| Einheit | Name | Bedeutung |
|---|---|---|
| kW | Kilowatt | Leistung (Arbeit pro Zeit) |
| kWh | Kilowattstunde | Energiemenge (1 kW für 1 Stunde) |
| kWp | Kilowatt-Peak | Maximale Solaranlagen-Leistung |
| % (η) | Wirkungsgrad | Nutzbare / aufgebrachte Energie |
| C | C-Rate | Lade-/Entladeleistung / Kapazität |
| % DoD | Depth of Discharge | Entladetiefe |
Fazit
Merksatz: Das Funktionsprinzip der Batterie basiert auf der galvanischen Zelle und chemischen Reaktionen. Mit einer Anode, Kathode, Separator und Elektrolyt werden Elektronen und Ionen voneinander getrennt – so entsteht nutzbare elektrische Spannung. Was vor über 200 Jahren mit Froschschenkeln und Metallscheiben begann, ist heute die Grundlage für Smartphones, Elektroautos und Solaranlagen.
Weiter geht's: Im nächsten Artikel Lithium vs. Blei: Welche Batterie für die Solaranlage? vergleichen wir die beiden wichtigsten Batterietechnologien für den Einsatz in Solaranlagen.
Die komplette Artikelserie „Energiespeicher für Solaranlagen"
- Von Froschschenkeln zu Batterien: Wie funktioniert ein Energiespeicher? – Sie sind hier
- Lithium vs. Blei: Welche Batterie für die Solaranlage? – Technologievergleich
- Leistungselektronik: Wechselrichter und DC-DC-Wandler – Stromwandlung
- Der Allrounder: Hybridwechselrichter – Alles in einem Gerät
- AC oder DC? Systemtopologien für Solaranlagen – Anlagenkonzepte