Dalle cosce di rana alle batterie: Come funziona un accumulo di energia?
Un po' di storia: La scoperta dell'elettricità
Luigi Galvani era un medico italiano e curioso scienziato del XVIII secolo. Durante un esperimento per studiare i muscoli delle cosce di rana, scoprì una connessione tra metalli stratificati e le contrazioni delle cosce di rana. Quando Galvani toccò accidentalmente i muscoli con una barra di ottone contro una griglia metallica, questi si contrassero. Era chiaro che l'elettricità aveva un ruolo – ma cosa esattamente accadesse fu stabilito solo alcuni anni dopo.
Il fisico italiano Alessandro Volta riconobbe, sulla base della scoperta di Galvani, che con l'aiuto di due dischi metallici diversi e un disco di cuoio imbevuto di acqua salata nel mezzo si poteva generare tensione elettrica. Volta impilò prima un disco di zinco, poi un disco di cuoio umido e infine un disco d'argento. Ripeté questo più volte e creò la pila voltaica – la prima batteria tecnicamente utilizzabile.
In onore di queste scoperte scientifiche:
- L'unità fisica della tensione (Volt) fu denominata in onore di Volta
- La combinazione di dischi di zinco, argento e cuoio fu chiamata cella galvanica
La cella galvanica costituisce la base per tutte le moderne celle di batteria.
Alcuni fondamenti: Metalli nobili e non nobili
Cosa c'è dietro la combinazione di argento, zinco e cuoio imbevuto di sale? Per rispondere, bisogna prima spiegare alcuni concetti fondamentali.
La capacità di cedere e assorbire elettroni dei metalli è l'elemento base per descrivere il funzionamento di una batteria:
| Tipo di metallo | Proprietà | Esempi |
|---|---|---|
| Metalli nobili | Non arrugginiscono, reagiscono poco con altre sostanze, trattengono gli elettroni e possono assorbirne altri | Argento, Oro, Platino |
| Metalli non nobili | Molto reattivi, arrugginiscono, cedono elettroni | Zinco, Ferro, Alluminio |
I termini più importanti della tecnologia delle batterie
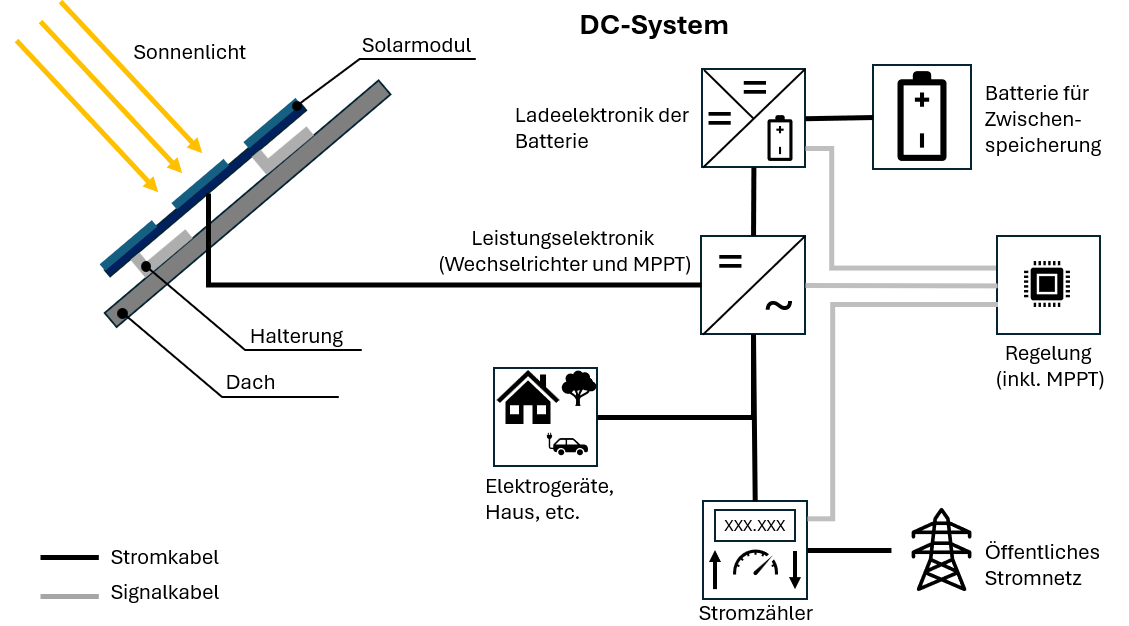
Anodo: L'elettrodo negativo (polo negativo), costituito da materiale non nobile, cede elettroni.
Catodo: L'elettrodo positivo (polo positivo), costituito da materiale nobile, assorbe elettroni.
Elettrolita: Un liquido o un solido che può condurre corrente elettrica con l'aiuto di particelle cariche (ioni).
Separatore: Separa anodo e catodo, ma lascia passare gli ioni – previene il cortocircuito.
Principio di funzionamento in dettaglio: Il processo di scarica
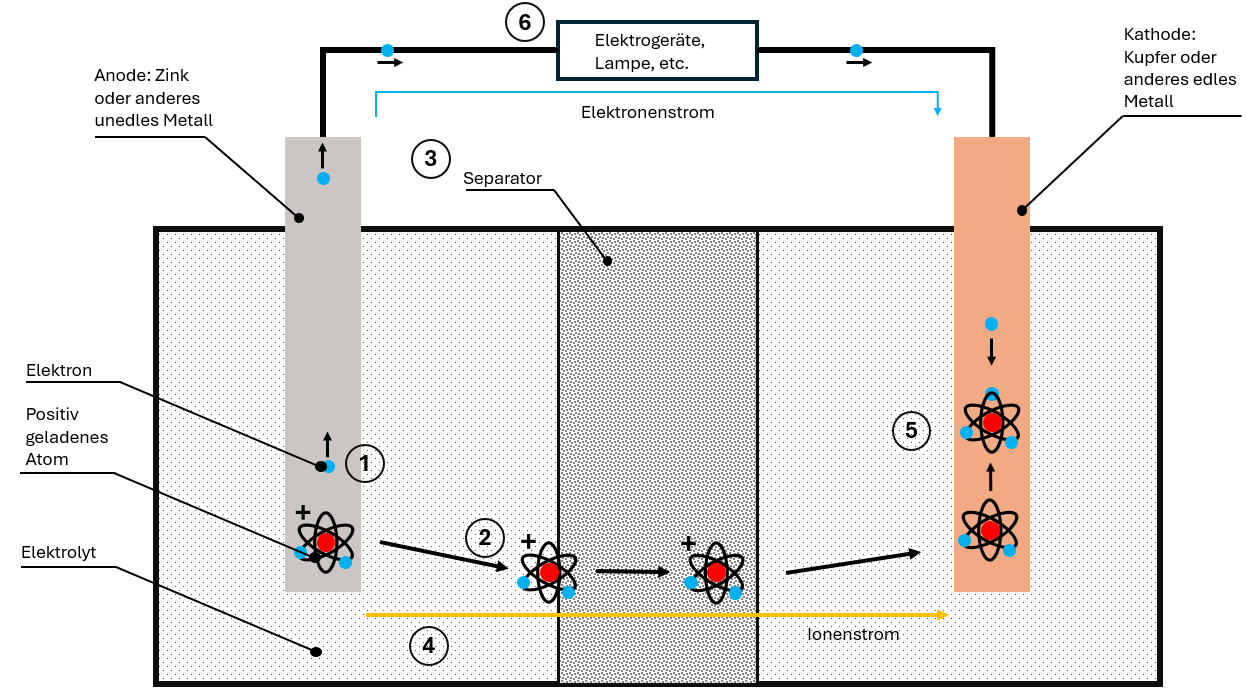
La cella di batteria standard è composta da quattro componenti:
- Anodo (polo negativo)
- Catodo (polo positivo)
- Elettrolita
- Separatore
Ecco come funziona la scarica:
- Cessione di elettroni: L'anodo non nobile cede elettroni che migrano attraverso il cavo verso il catodo
- Formazione di ioni: A causa della mancanza di elettroni si formano ioni caricati positivamente nell'anodo
- Migrazione degli ioni: Gli ioni si sciolgono nell'elettrolita e migrano attraverso il separatore verso il catodo
- Due correnti separate:
- Corrente di elettroni attraverso il cavo (utilizzabile!)
- Corrente di ioni attraverso l'elettrolita
- Riunificazione: Nel catodo elettroni e ioni si riuniscono
La corrente di elettroni è corrente continua – scorre sempre in una direzione e può essere utilizzata per apparecchi elettrici. L'energia chimica viene così convertita in energia elettrica.
Il processo di carica: Tutto al contrario
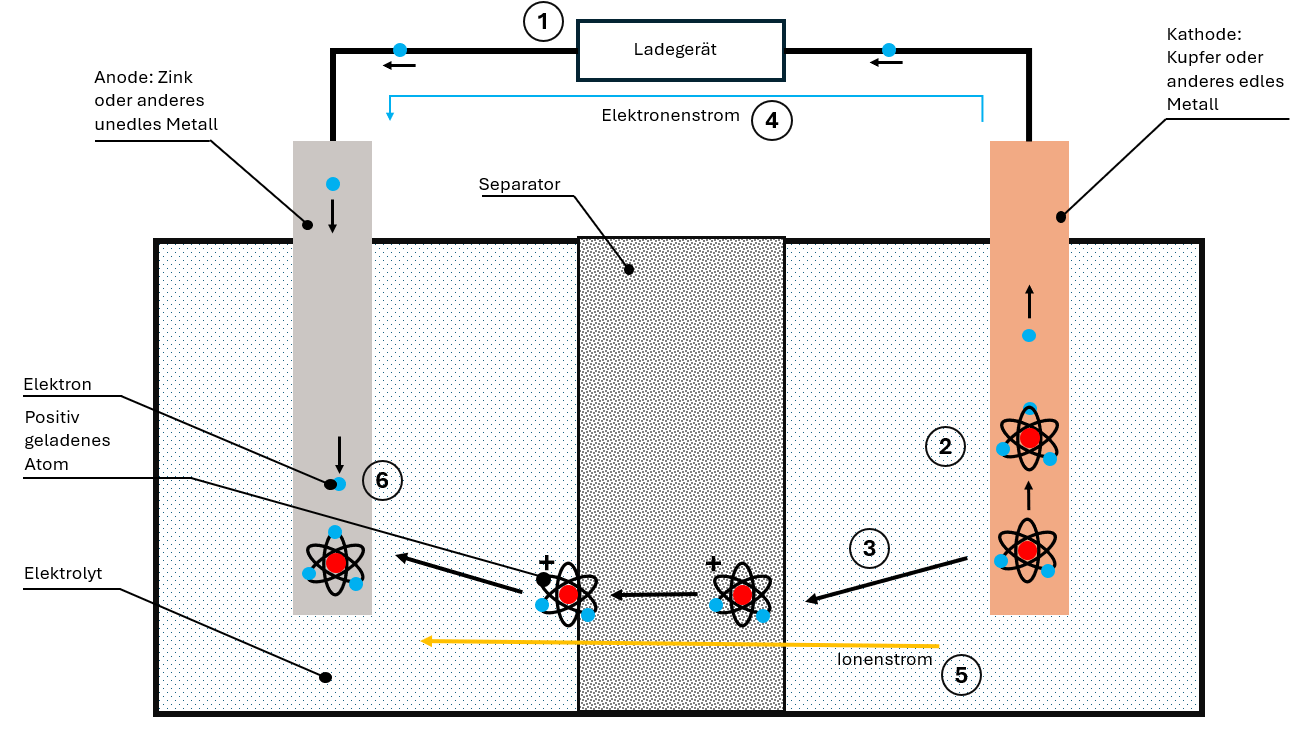
Durante la carica viene applicata dal caricatore una tensione opposta. In questo modo l'intero processo si inverte:
- Il catodo "perde" i suoi elettroni, che migrano verso l'anodo
- Gli ioni si staccano dal materiale del catodo
- Gli ioni si muovono attraverso elettrolita e separatore verso l'anodo
- Nell'anodo ioni ed elettroni vengono nuovamente incorporati
La batteria è di nuovo caricata e pronta per il prossimo ciclo di scarica.
Termini tecnici e unità importanti
Durata e cicli di carica
Un ciclo di carica è il processo di una completa scarica e ricarica. Le moderne batterie agli ioni di litio raggiungono, a seconda del tipo, tra 1.000 e 4.000 cicli.
Profondità di scarica (DoD – Depth of Discharge)
La profondità di scarica indica a quale percentuale la batteria è stata scaricata:
- 0% DoD = Batteria completamente carica
- 100% DoD = Batteria completamente scarica (da evitare!)
Ogni tipo di batteria ha una profondità di scarica massima consigliata. Scendendo al di sotto di questa soglia la batteria viene danneggiata.
C-Rate: Velocità di carica e scarica
La C-Rate descrive il rapporto tra potenza di carica/scarica e capacità:
C-Rate = Potenza (kW) / Capacità (kWh)
| C-Rate | Tempo di carica/scarica | Significato |
|---|---|---|
| 0,25C | 4 ore | Carica delicata |
| 0,5C | 2 ore | Standard accumuli domestici |
| 1C | 1 ora | Ricarica rapida |
| 2C | 30 minuti | Alta prestazione |
Esempio: Una batteria con 10 kW di potenza e 20 kWh di capacità ha una C-Rate di 0,5C – si carica o scarica in 2 ore.
Densità energetica
Il rapporto tra energia accumulata e volume:
- Volumetrica: Wh per litro (Wh/l)
- Gravimetrica: Wh per chilogrammo (Wh/kg)
Le batterie agli ioni di litio con catodi LFP raggiungono circa 200 Wh/kg – significativamente di più delle batterie al piombo-acido.
Effetto memoria
Questo fenomeno descrive la riduzione della capacità causata dalla ricarica di una batteria non completamente scaricata. La batteria "ricorda" il ciclo di carica abbreviato e rilascia solo una parte corrispondente della capacità.
Buono a sapersi: Le moderne batterie agli ioni di litio sono praticamente immuni dall'effetto memoria – a differenza delle vecchie batterie nichel-cadmio.
Panoramica: Le unità più importanti
Per lavorare con batterie e impianti solari, alcune unità e indicatori sono particolarmente importanti. La tabella seguente riassume le grandezze essenziali:
| Unità | Nome | Significato |
|---|---|---|
| kW | Kilowatt | Potenza (lavoro per unità di tempo) |
| kWh | Kilowattora | Quantità di energia (1 kW per 1 ora) |
| kWp | Kilowatt-picco | Potenza massima dell'impianto solare |
| % (η) | Rendimento | Energia utilizzabile / energia impiegata |
| C | C-Rate | Potenza di carica/scarica / Capacità |
| % DoD | Depth of Discharge | Profondità di scarica |
Conclusioni
In sintesi: Il principio di funzionamento della batteria si basa sulla cella galvanica e sulle reazioni chimiche. Con un anodo, un catodo, un separatore e un elettrolita, elettroni e ioni vengono separati – così si genera tensione elettrica utilizzabile. Ciò che oltre 200 anni fa iniziò con cosce di rana e dischi metallici è oggi alla base di smartphone, auto elettriche e impianti solari.
Per approfondire: Litio vs. Piombo: Quale batteria per l'impianto solare?
La serie completa "Accumulo di energia per impianti solari"
- Dalle cosce di rana alle batterie: Come funziona un accumulo di energia? – Questo articolo
- Litio vs. Piombo: Quale batteria per l'impianto solare? – Confronto tecnologico
- Elettronica di potenza: Inverter e convertitori DC-DC – Conversione di corrente
- Il tuttofare: Inverter ibridi – Tutto in un dispositivo
- AC o DC? Topologie di sistema per impianti solari – Configurazioni impiantistiche
