Van kikkerbillen tot batterijen: hoe werkt een energieopslag?
Een beetje geschiedenis: de ontdekking van elektriciteit
Luigi Galvani was een Italiaanse arts en nieuwsgierige wetenschapper in de 18e eeuw. Tijdens een experiment met de spieren van kikkerbillen ontdekte hij een verband tussen op elkaar gestapelde metalen en het samentrekken van de spieren. Toen Galvani de spieren per ongeluk met een messingstaaf tegen een metalen rooster stootte, trokken ze samen. Hij begreep dat elektriciteit hierbij een rol speelde – maar wat er precies gebeurde, werd pas enkele jaren later duidelijk.
De Italiaanse natuurkundige Alessandro Volta ontdekte op basis van Galvani’s waarnemingen dat je met twee verschillende metalen schijfjes en daartussen een met zout water doordrenkte leren schijf elektrische spanning kunt opwekken. Volta stapelde eerst een zinkschijf, dan een vochtige leren schijf en vervolgens een zilverschijf. Dit herhaalde hij meerdere keren en zo ontstond de Volta-zuil – de eerste technisch bruikbare batterij.
Ter ere van deze wetenschappelijke ontdekkingen werd:
- De natuurkundige eenheid van spanning (volt) naar Volta genoemd
- De combinatie van zink-, zilver- en leerschijven de galvanische cel genoemd
De galvanische cel vormt de basis voor alle moderne batterijcellen.
Een paar basisbegrippen: edele en onedele metalen
Wat is er zo bijzonder aan de combinatie van zilver, zink en met zout doordrenkt leer? Om dat te begrijpen, moeten eerst enkele basisbegrippen worden uitgelegd.
Het vermogen van metalen om elektronen af te staan of op te nemen is de fundamentele bouwsteen om de werking van een batterij te beschrijven:
| Metaaltype | Eigenschappen | Voorbeelden |
|---|---|---|
| Edele metalen | Rosten niet, reageren weinig met andere stoffen, houden elektronen vast en kunnen extra elektronen opnemen | Zilver, goud, platina |
| Onedele metalen | Zeer reactief, roesten, staan gemakkelijk elektronen af | Zink, ijzer, aluminium |
De belangrijkste begrippen in de batterijtechniek
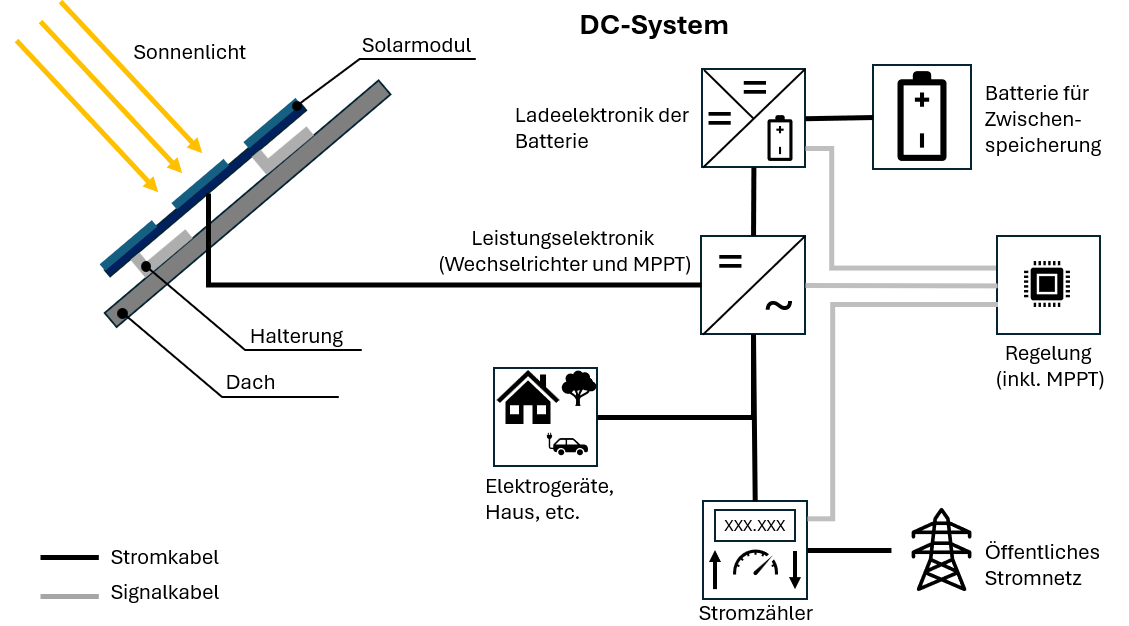
Anode: De negatieve elektrode (minpool), bestaat uit onedel materiaal en staat elektronen af.
Kathode: De positieve elektrode (pluspool), bestaat uit edel materiaal en neemt elektronen op.
Elektrolyt: Een vloeistof of vaste stof die met behulp van geladen deeltjes (ionen) elektrische stroom kan geleiden.
Separator: Scheidt anode en kathode, maar laat ionen door – voorkomt kortsluiting.
Werkingsprincipe in detail: het ontladen
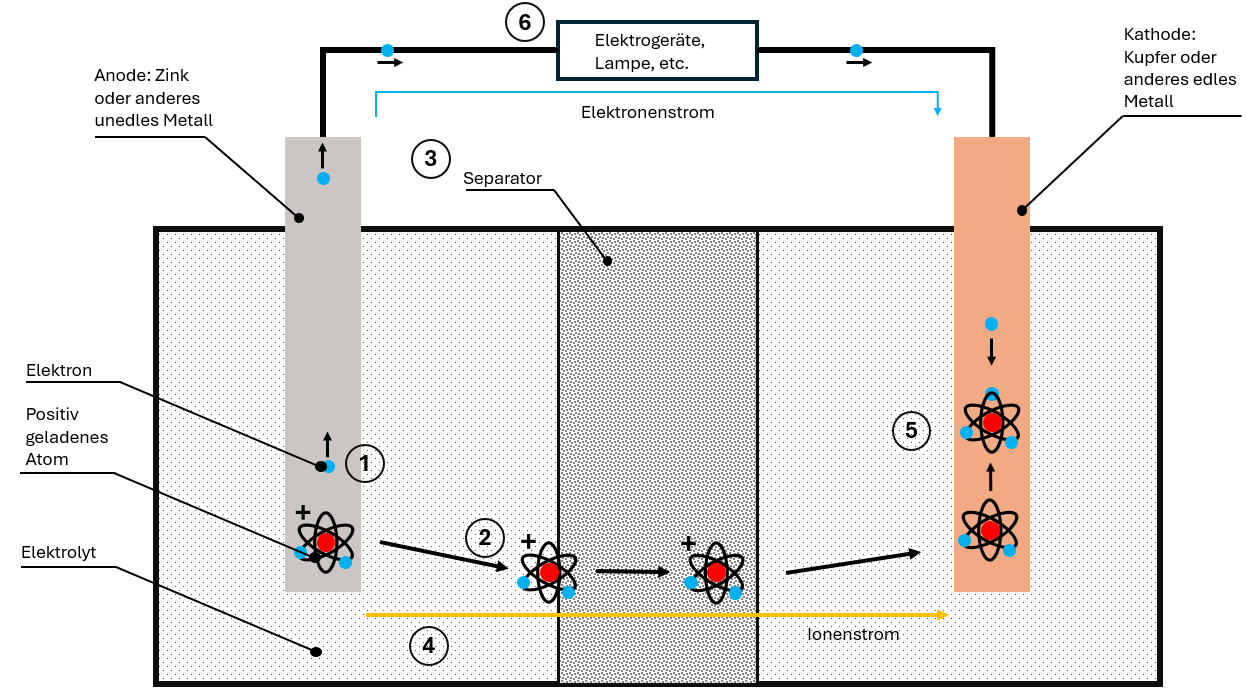
De standaard batterijcel bestaat uit vier componenten:
- Anode (minpool)
- Kathode (pluspool)
- Elektrolyt
- Separator
Zo verloopt het ontladen:
- Elektronenafgifte: De onedele anode staat elektronen af, die via de geleider naar de kathode stromen.
- Vorming van ionen: Door het tekort aan elektronen ontstaan in de anode positief geladen ionen.
- Ionentransport: De ionen lossen op in het elektrolyt en migreren via de separator naar de kathode.
- Twee gescheiden stromen:
- Elektronenstroom via de geleider (bruikbaar!)
- Ionenstroom door het elektrolyt
- Hereniging: In de kathode komen elektronen en ionen weer samen.
De elektronenstroom is gelijkstroom – hij vloeit steeds in dezelfde richting en kan voor elektrische apparaten worden gebruikt. Chemische energie wordt zo omgezet in elektrische energie.
Het laadproces: alles omgekeerd
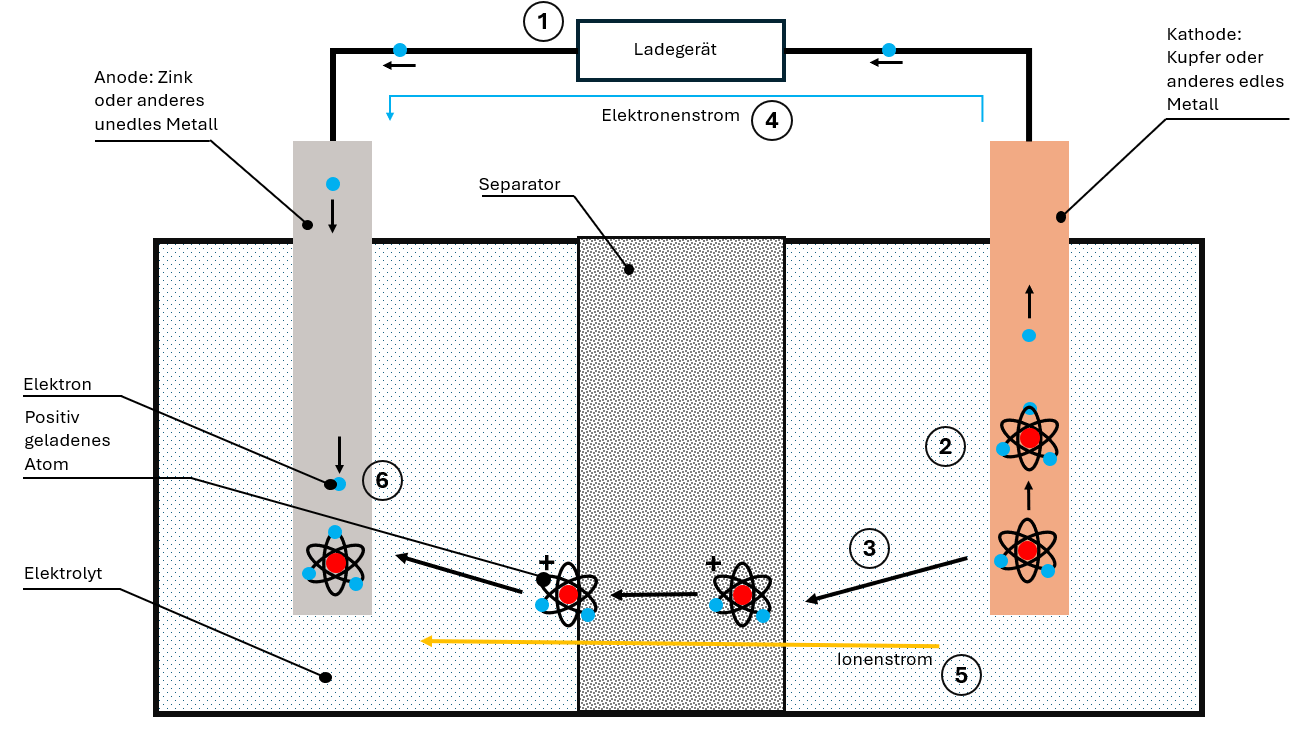
Bij het laden legt de lader een tegengestelde spanning aan. Daardoor keert het hele proces zich om:
- De kathode “verliest” elektronen, die naar de anode stromen.
- Ionen komen vrij uit het kathodemateriaal.
- De ionen bewegen zich via elektrolyt en separator naar de anode.
- In de anode worden ionen en elektronen opnieuw ingebouwd.
De batterij is weer opgeladen en klaar voor de volgende ontlaadcyclus.
Belangrijke vakbegrippen en eenheden
Levensduur en laadcycli
Een laadcyclus is één volledige ont- en oplading. Moderne lithium‑ionbatterijen halen, afhankelijk van het type, tussen de 1.000 en 4.000 cycli.
Ontlaaddiepte (DoD – Depth of Discharge)
De ontlaaddiepte geeft aan tot welk percentage de batterij is ontladen:
- 0% DoD = batterij volledig geladen
- 100% DoD = batterij volledig ontladen (vermijden!)
Elke batterijtechnologie heeft een maximaal aanbevolen ontlaaddiepte. Als u daaronder komt, raakt de batterij beschadigd.
C‑rate: laad- en ontlaadsnelheid
De C‑rate beschrijft de verhouding tussen laad-/ontlaadvermogen en capaciteit:
C‑rate = vermogen (kW) / capaciteit (kWh)
| C‑rate | Laad-/ontlaadtijd | Betekenis |
|---|---|---|
| 0,25C | 4 uur | Zachte, batterijvriendelijke lading |
| 0,5C | 2 uur | Standaard voor thuisbatterijen |
| 1C | 1 uur | Snel laden |
| 2C | 30 minuten | Hoog vermogen |
Voorbeeld: Een batterij met 10 kW vermogen en 20 kWh capaciteit heeft een C‑rate van 0,5C – ze laadt of ontlaadt in 2 uur.
Energiedichtheid
De verhouding tussen opgeslagen energie en benodigde ruimte of massa:
- Volumetrisch: Wh per liter (Wh/l)
- Gravimetrisch: Wh per kilogram (Wh/kg)
Lithium‑ionbatterijen met LFP‑kathoden halen ongeveer 200 Wh/kg – aanzienlijk meer dan loodzuurbatterijen.
Geheugeneffect (memory‑effect)
Dit verschijnsel beschrijft de vermindering van de bruikbare capaciteit door herhaald opladen van een niet volledig ontladen batterij. De batterij “onthoudt” de verkorte laadcyclus en levert daarna nog maar een overeenkomstig deel van de capaciteit.
Goed om te weten: Moderne lithium‑ionbatterijen hebben in de praktijk vrijwel geen last van het geheugeneffect – in tegenstelling tot oudere nikkel‑cadmiumbatterijen.
Overzicht: de belangrijkste eenheden
Voor het werken met batterijen en zonne‑energiesystemen zijn enkele eenheden en kengetallen bijzonder relevant. De volgende tabel vat de belangrijkste grootheden samen:
| Eenheid | Naam | Betekenis |
|---|---|---|
| kW | kilowatt | Vermogen (arbeid per tijdseenheid) |
| kWh | kilowattuur | Hoeveelheid energie (1 kW gedurende 1 uur) |
| kWp | kilowatt‑piek | Maximaal vermogen van een pv‑installatie |
| % (η) | Rendement | Bruikbare / toegevoerde energie |
| C | C‑rate | Laad-/ontlaadvermogen / capaciteit |
| % DoD | Depth of Discharge | Ontlaaddiepte |
Conclusie
Het belangrijkste: Het werkingsprincipe van de batterij is gebaseerd op de galvanische cel en chemische reacties. Met een anode, kathode, separator en elektrolyt worden elektronen en ionen van elkaar gescheiden – zo ontstaat bruikbare elektrische spanning. Wat ruim 200 jaar geleden begon met kikkerbillen en metalen schijfjes, is vandaag de basis voor smartphones, elektrische auto’s en zonne‑energiesystemen met thuisbatterij.
Wie dieper wil instappen: Lithium vs. lood: welke batterij voor de zonne-installatie?
De complete artikelenreeks „Energieopslag voor zonne-installaties”
- Van kikkerbillen tot batterijen: hoe werkt een energieopslag? – u bent hier
- Lithium vs. lood: welke batterij voor de zonne-installatie? – Technologievergelijking
- Vermogenselektronica: omvormers en DC‑DC‑omzetters – Stroomomzetting
- De alleskunner: hybride omvormer – Alles in één toestel
- AC of DC? Systeemtopologieën voor zonne-installaties – Installatieconcepten
