Das coxas de rã às baterias: como funciona um acumulador de energia?
Um pouco de história: a descoberta da eletricidade
Luigi Galvani foi um médico italiano e um cientista curioso do século XVIII. Durante uma experiência para estudar os músculos das coxas de rã, descobriu uma relação entre metais sobrepostos e o espasmo desses músculos. Quando Galvani tocou acidentalmente os músculos com uma haste de latão encostada a uma grelha metálica, as coxas de rã contraíram-se. Ficou claro para ele que a eletricidade tinha um papel neste fenómeno – mas o que acontecia exatamente só foi esclarecido alguns anos mais tarde.
O físico italiano Alessandro Volta, partindo da descoberta de Galvani, percebeu que, com a ajuda de dois discos metálicos diferentes e um disco de couro embebido em água salgada entre eles, se podia gerar uma diferença de potencial elétrico. Volta empilhou primeiro um disco de zinco, depois um disco de couro húmido e, por fim, um disco de prata. Repetiu esta sequência várias vezes e criou a coluna de Volta – a primeira bateria tecnicamente utilizável.
Em homenagem a estas descobertas científicas:
- A unidade física de tensão (Volt) recebeu o nome de Volta
- O conjunto de discos de zinco, prata e couro passou a ser designado por célula galvânica
A célula galvânica é a base de todas as células de bateria modernas.
Alguns fundamentos: metais nobres e não nobres
O que está por detrás da combinação de prata, zinco e couro embebido em sal? Para responder, é preciso esclarecer primeiro alguns conceitos básicos.
A capacidade de doar e receber eletrões dos metais é o elemento fundamental para descrever o funcionamento de uma bateria:
| Tipo de metal | Propriedades | Exemplos |
|---|---|---|
| Metais nobres | Não enferrujam, reagem pouco com outras substâncias, retêm eletrões e podem receber mais | Prata, ouro, platina |
| Metais não nobres | Muito reativos, enferrujam, libertam eletrões | Zinco, ferro, alumínio |
Conceitos essenciais da tecnologia de baterias
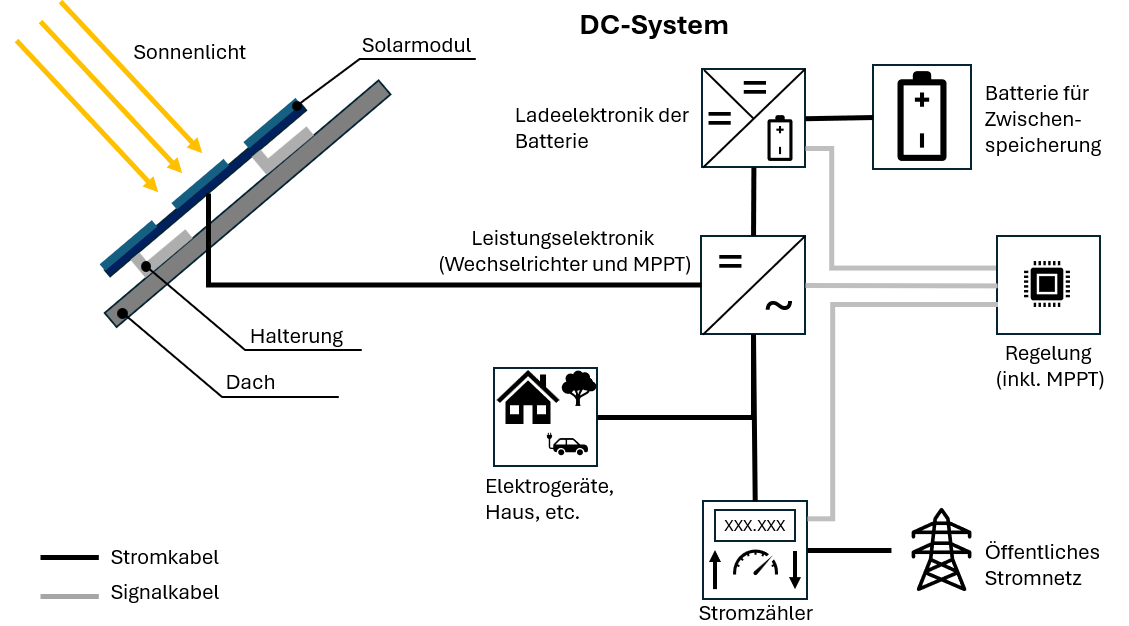
Ânodo: Eletrodo negativo (polo menos), constituído por material não nobre, cede eletrões.
Cátodo: Eletrodo positivo (polo mais), constituído por material nobre, recebe eletrões.
Eletrólito: Líquido ou sólido que conduz corrente elétrica através de partículas carregadas (iões).
Separador: Separa ânodo e cátodo, mas deixa passar iões – evita curto‑circuitos.
Princípio de funcionamento em detalhe: o processo de descarga
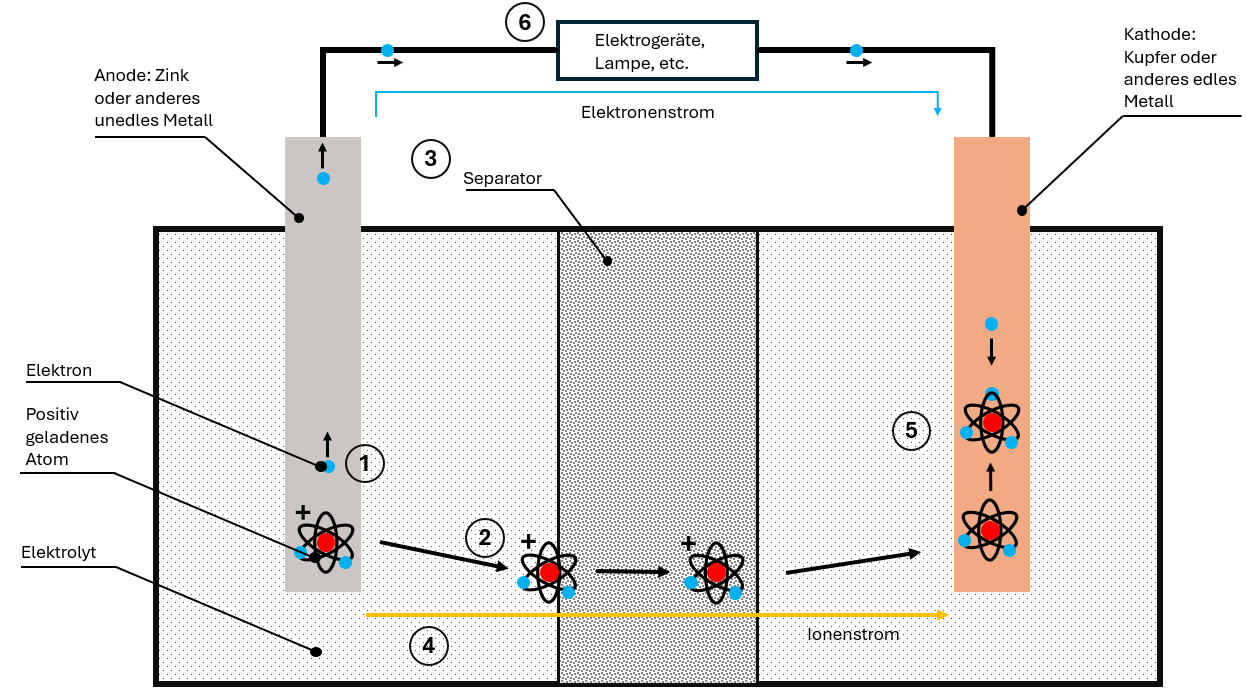
A célula de bateria “típica” é composta por quatro elementos:
- Ânodo (polo negativo)
- Cátodo (polo positivo)
- Eletrólito
- Separador
Assim funciona a descarga:
- Libertação de eletrões: O ânodo não nobre liberta eletrões, que circulam através do cabo até ao cátodo
- Formação de iões: Devido à falta de eletrões, formam‑se iões com carga positiva no ânodo
- Migração de iões: Os iões dissolvem‑se no eletrólito e migram através do separador em direção ao cátodo
- Dois fluxos separados:
- Fluxo de eletrões pelo cabo (é o que utilizamos!)
- Fluxo de iões através do eletrólito
- Reencontro: No cátodo, eletrões e iões voltam a juntar‑se
O fluxo de eletrões é corrente contínua – circula sempre no mesmo sentido e pode ser utilizado para alimentar equipamentos elétricos. A energia química é assim convertida em energia elétrica.
O processo de carga: tudo ao contrário
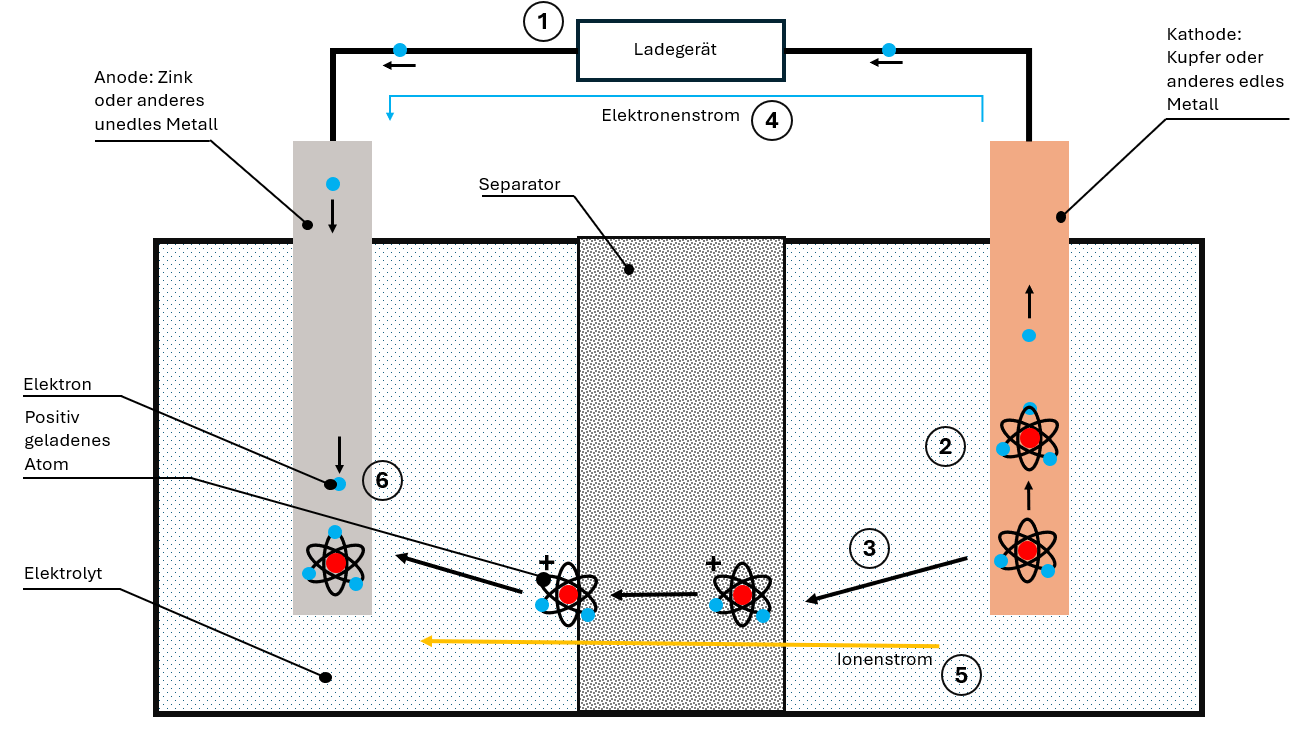
Durante a carga, o carregador aplica uma tensão em sentido contrário. Todo o processo se inverte:
- O cátodo “perde” os seus eletrões, que migram para o ânodo
- Iões são libertados do material do cátodo
- Os iões deslocam‑se através do eletrólito e do separador até ao ânodo
- No ânodo, iões e eletrões voltam a ser armazenados em conjunto
A bateria fica novamente carregada e pronta para o ciclo de descarga seguinte.
Conceitos e unidades importantes
Vida útil e ciclos de carga
Um ciclo de carga é o processo de uma descarga e carga completas. As baterias modernas de iões de lítio conseguem, consoante o tipo, entre 1 000 e 4 000 ciclos.
Profundidade de descarga (DoD – Depth of Discharge)
A profundidade de descarga indica a percentagem de energia que foi retirada da bateria:
- 0% DoD = bateria totalmente carregada
- 100% DoD = bateria totalmente descarregada (a evitar!)
Cada tipo de bateria tem uma profundidade de descarga máxima recomendada. Se for ultrapassada, a bateria sofre danos.
Taxa C: velocidade de carga e descarga
A taxa C descreve a relação entre a potência de carga/descarga e a capacidade:
Taxa C = Potência (kW) / Capacidade (kWh)
| Taxa C | Tempo de carga/descarga | Significado |
|---|---|---|
| 0,25C | 4 horas | Carga suave |
| 0,5C | 2 horas | Padrão em sistemas domésticos |
| 1C | 1 hora | Carga rápida |
| 2C | 30 minutos | Alta potência |
Exemplo: Uma bateria com 10 kW de potência e 20 kWh de capacidade tem uma taxa de 0,5C – carrega ou descarrega em 2 horas.
Densidade de energia
Relação entre a energia armazenada e o espaço ocupado:
- Volumétrica: Wh por litro (Wh/l)
- Gravimétrica: Wh por quilograma (Wh/kg)
Baterias de iões de lítio com cátodos LFP atingem cerca de 200 Wh/kg – significativamente mais do que baterias de chumbo‑ácido.
Efeito de memória (memory effect)
Este fenómeno descreve a redução da capacidade quando uma bateria é carregada repetidamente sem ser totalmente descarregada. A bateria “recorda‑se” do ciclo de carga encurtado e passa a disponibilizar apenas essa fração da capacidade.
Importante: As baterias modernas de iões de lítio são praticamente imunes ao efeito de memória – ao contrário das antigas baterias de níquel‑cádmio.
Visão geral: as unidades mais relevantes
Para trabalhar com baterias e sistemas solares, há algumas unidades e indicadores particularmente importantes. A tabela seguinte resume as grandezas essenciais:
| Unidade | Nome | Significado |
|---|---|---|
| kW | Quilowatt | Potência (trabalho por unidade de tempo) |
| kWh | Quilowatt‑hora | Quantidade de energia (1 kW durante 1 hora) |
| kWp | Quilowatt‑pico | Potência máxima de um sistema fotovoltaico |
| % (η) | Rendimento | Energia útil / energia fornecida |
| C | Taxa C | Potência de carga/descarga / capacidade |
| % DoD | Depth of Discharge | Profundidade de descarga |
Conclusão
Essencial: O princípio de funcionamento da bateria baseia‑se na célula galvânica e em reações químicas. Com um ânodo, um cátodo, um separador e um eletrólito, eletrões e iões são conduzidos por caminhos diferentes – assim se gera uma tensão elétrica utilizável.
O que começou há mais de 200 anos com coxas de rã e discos metálicos é hoje a base de smartphones, veículos elétricos e sistemas solares.
Para quem quiser aprofundar: Lítio vs. chumbo: que bateria para a instalação solar?
Série completa de artigos “Acumuladores de energia para sistemas solares”
- Das coxas de rã às baterias: como funciona um acumulador de energia? – Está aqui
- Lítio vs. chumbo: que bateria para a instalação solar? – Comparação de tecnologias
- Eletrónica de potência: inversores e conversores DC‑DC – Conversão de corrente
- O polivalente: inversor híbrido – Tudo num só equipamento
- AC ou DC? Topologias de sistema para instalações solares – Conceitos de sistema
